東區醫院3月初被揭發使用未經香港註冊、內地製的抗生素。FactWire傳真社調查發現,醫管局透過原本為特定病人引入新藥或罕見病藥物的「Named Patient」(指定病人) 計劃,將未經註冊的常用藥物引入公共醫院,今年1月至4月收集到資料的6間醫院至少有82款藥物未經註冊,醫生處方時未必知情,藥房派藥亦不會主動告知病人。

東區醫院3月初被揭發使用未經香港註冊、內地製的抗生素,醫管局當時回應指個別藥物出現供應問題,別無選擇下有機會進口未經註冊藥物。FactWire傳真社調查發現,公立醫院使用未經註冊藥物的情況普遍,今年1月至4月收集到資料的6間醫院至少有82款藥物未經註冊,包括治療癌症、新冠肺炎藥物或抗生素等。調查進一步發現,醫管局透過原本為特定病人引入新藥或罕見病藥物的「Named Patient」(指定病人) 計劃,將未經註冊的常用藥物引入公共醫院,醫生處方時未必知情,藥房派藥亦不會主動告知病人。
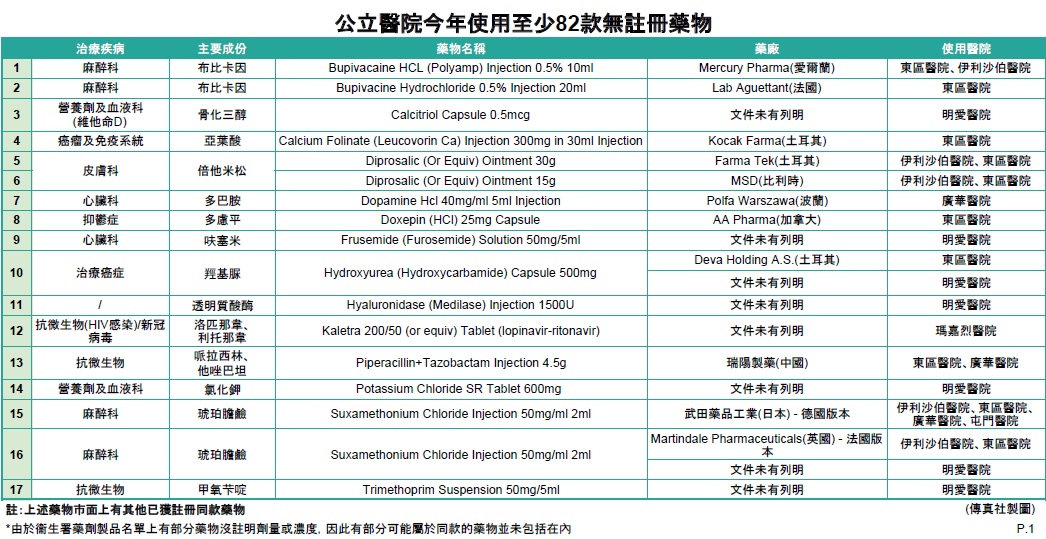
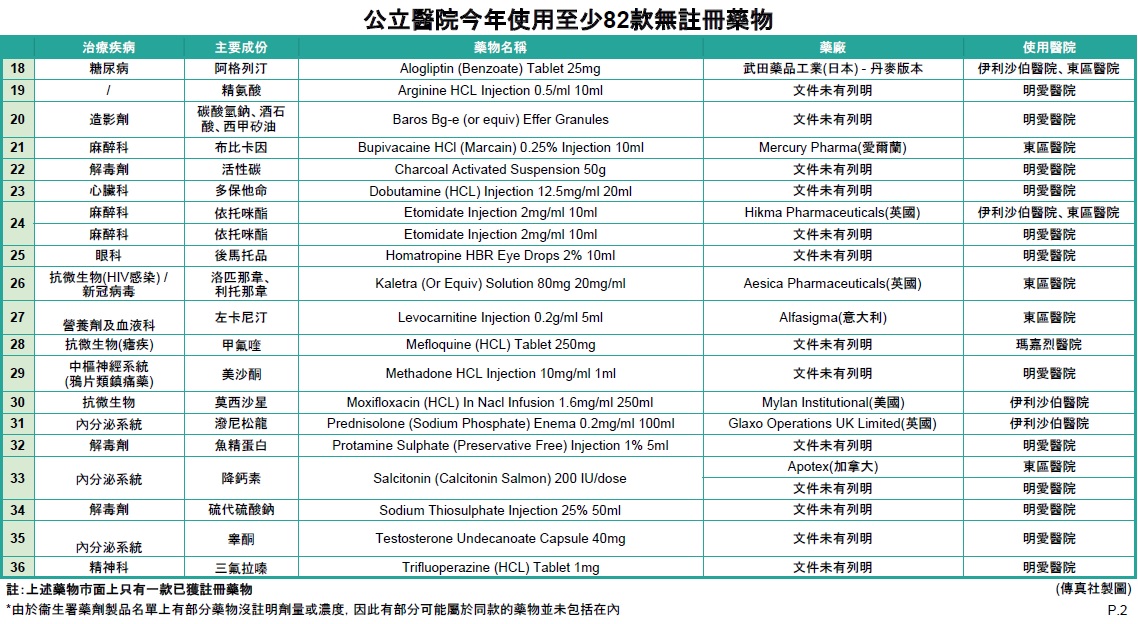
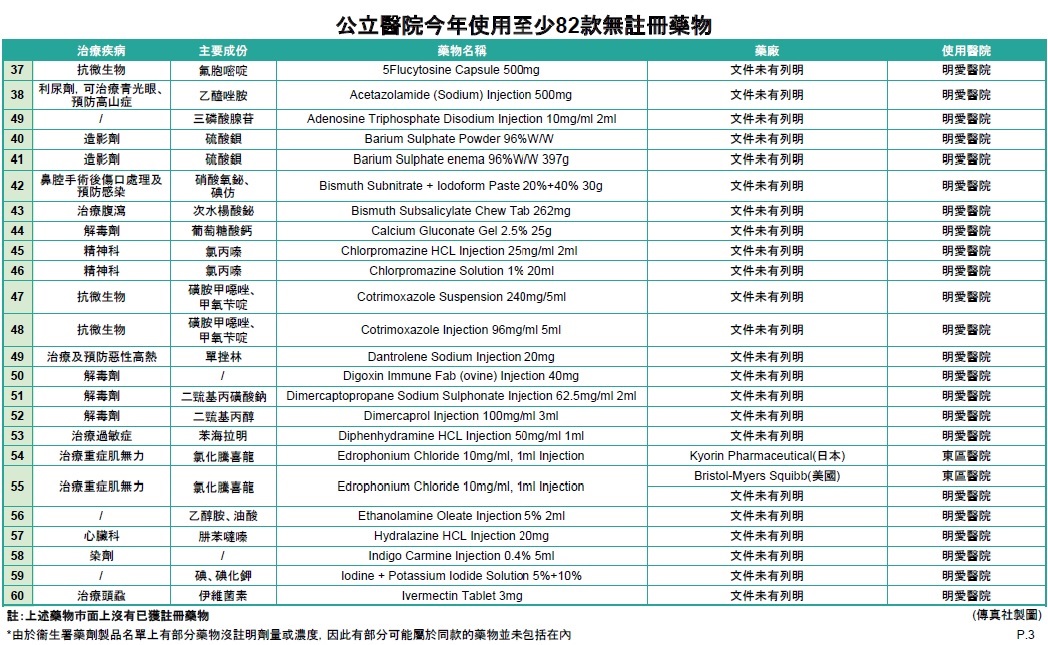
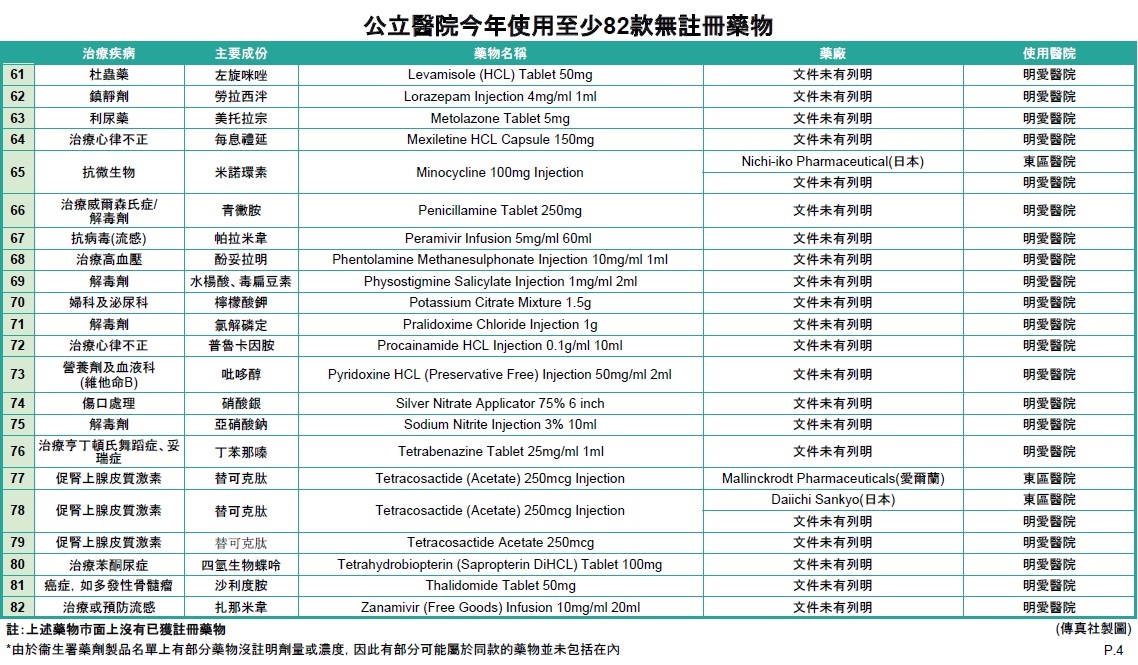
傳真社成功收集6間公立醫院有關藥物使用或更換的內部電郵及文件,發現東區醫院、伊利沙伯醫院、明愛醫院、屯門醫院、廣華醫院及瑪嘉烈醫院於1月至4月期間,均有採用未經香港註冊的藥物,涉及抗生素、麻醉科、心臟科、泌尿科、皮膚科、癌症、抑鬱症,以及用作治療新冠肺炎的蛋白酶抑制劑Kaletra等至少82款藥物 (詳情見表一)。當中至少17款在巿面上有其他已獲註冊的同款藥物,19款是巿面上只有一款同款藥物,未知不獲醫管局採用原因,46款沒有已經註冊的同款藥物。
除了瑪嘉烈醫院有在相關電郵上列明藥物未經香港註冊,安全、療效及質素未被評估,按衞生署建議醫護人員給予病人適當警告外,其餘醫院文件及電郵均未見有提醒醫護人員要知會病人。

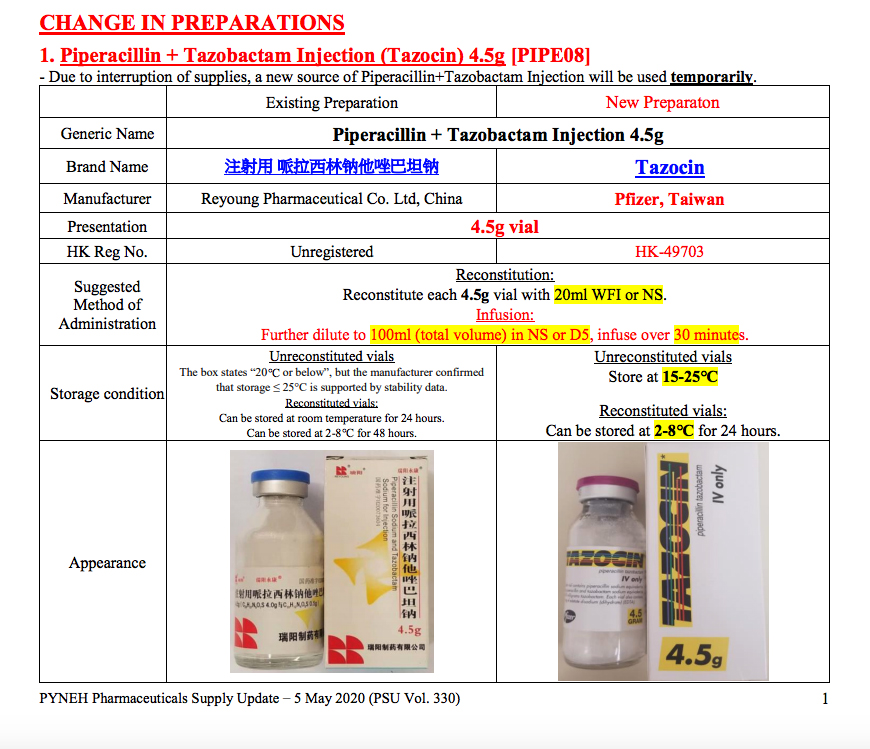
這批未經香港註冊的藥物中,包括3月初東區醫院被揭發使用由山東瑞陽製藥生產的抗生素「注射用哌拉西林钠他唑巴坦钠」,即「Piperacillin + Tazobactam Injection 4.5g」。東區醫院內部文件顯示,3月27日已換回香港註冊、由印度Aurobindo Pharma生產的同款藥物。不過廣華醫院卻於3月20日發出通知,表示因供應中斷(interruption of supply)改用山東瑞陽製藥版本,代替醫院原先使用由Aurobindo Pharma生產的同款藥物,與東區醫院的供應情況恰巧相反。其後東區醫院於4月底再次採用山東瑞陽製藥的抗生素,5月初又換回美國輝瑞藥廠生產已獲註冊版本,換藥情況頻繁。



另一款主要成份為琥珀膽鹼的麻醉科藥物「Suxamethonium Chloride Injection 50mg/ml 2ml」,內部電郵及文件顯示,伊利沙伯醫院、東區醫院、廣華醫院、明愛醫院及屯門醫院5間醫院均有使用未經香港註冊的相關藥物。除了明愛醫院未知相關藥物所屬藥廠,其餘4間醫院3月起先後發通知,提醒醫護人員改用由日本武田藥品工業(Takeda GMBH)生產的德國版同款藥物,翻查衞生署紀錄該藥並無註冊。
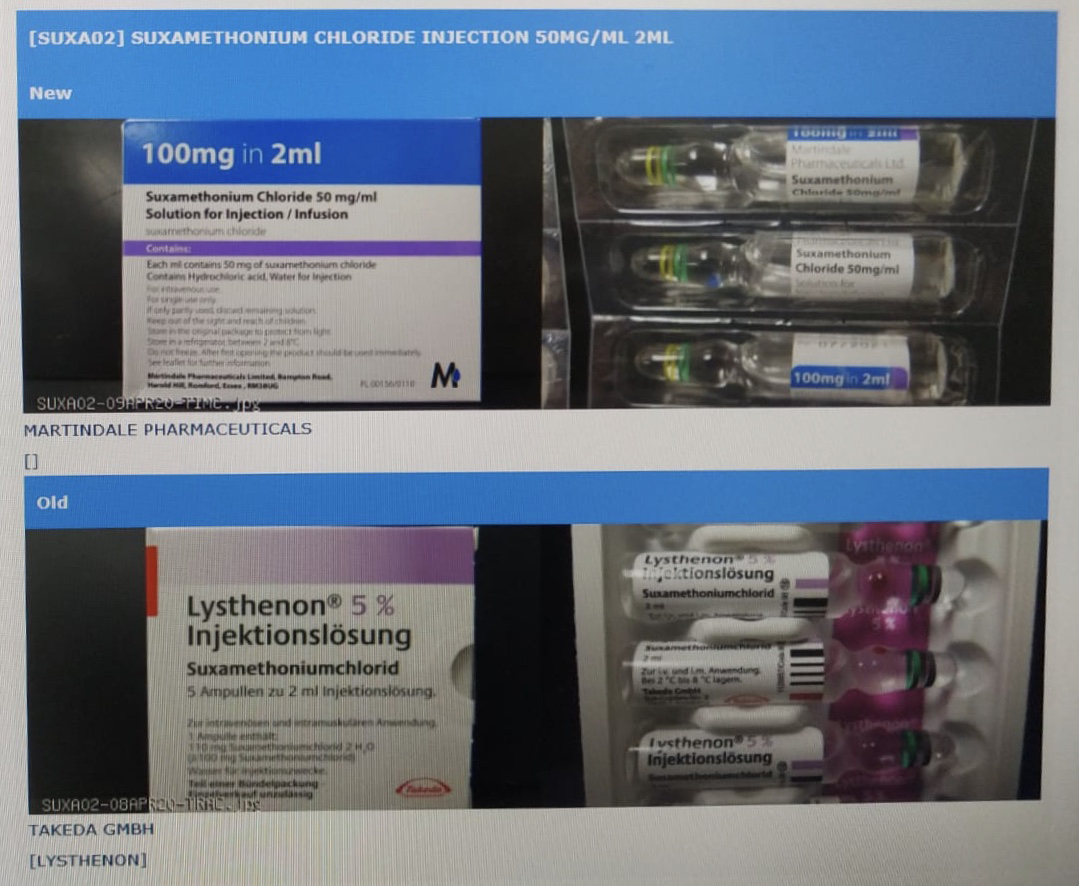
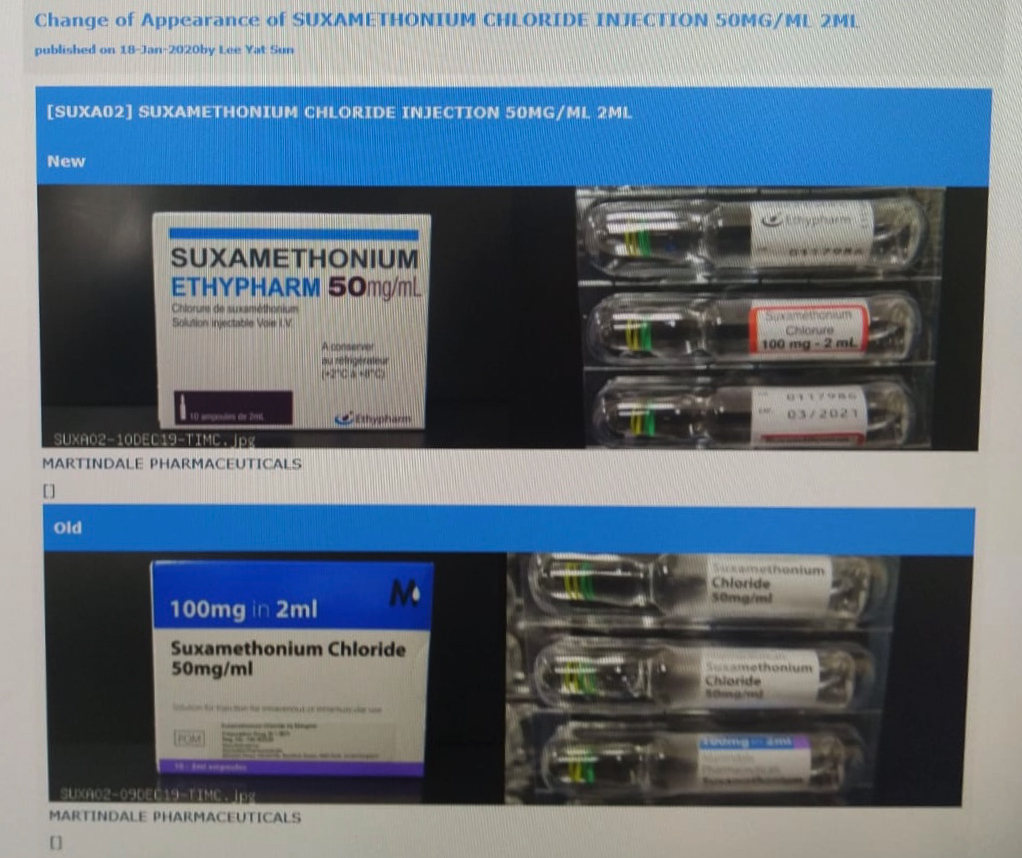
改用日本武田藥品之前,伊利沙伯醫院及東區醫院曾使用由英國Martindale Pharmaceuticals生產的同款麻醉科藥物。Martindale Pharmaceuticals生產的琥珀膽鹼藥物於香港有註冊,由全球藥業有限公司代理,包裝上印有英文說明及註冊編號HK-60239,惟兩間醫院使用的藥物,包裝上印有法文字樣,衞生署沒有相關註冊紀錄,相信是藥廠原定出口法國的藥物。
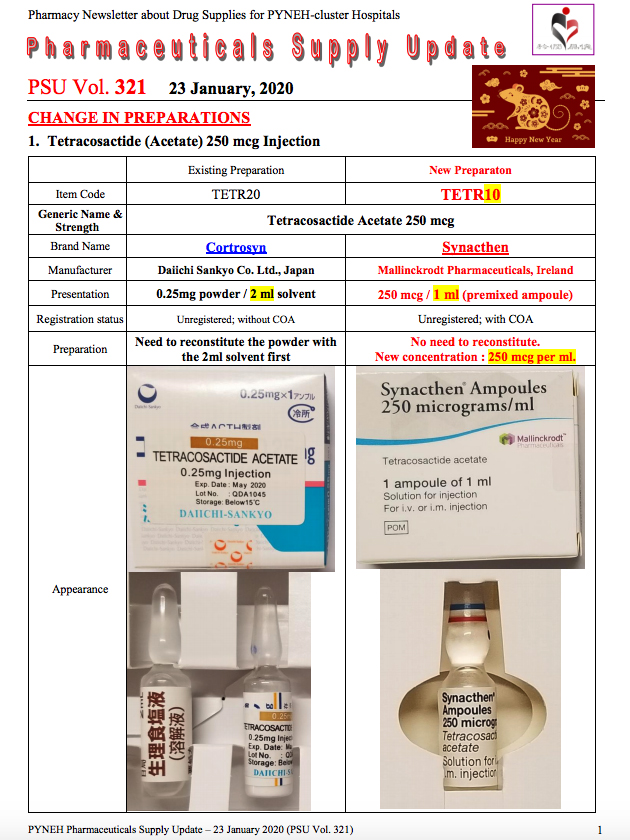
另外,東區醫院1月23日曾就促腎上腺皮質激素「Tetracosactide (Acetate) 250 mcg Injection」發出換藥通知,指示由日本Daiichi Sankyo生產的「Cortrosyn」,轉為由愛爾蘭Mallinckrodt Pharmaceuticals生產的「Synacthen」,兩者均列明未經註冊。其中「Cortrosyn」的註冊狀態一欄列明「without COA」,相信是指該藥沒有化驗分析證明書(Certificate of Analysis)。然而根據衞生署藥物辦公室網頁資料,無論是為治療某特定病人而需進口未經註冊藥物,或是一般藥物註冊申請,都必須提交由製造商或進行測試公司發出該藥物的化驗分析證明書。
據了解公立醫院一直都有使用藥廠原定供往其他地方的藥物,有威爾斯親王醫院內部文件顯示,2019年5月該院曾使用美國輝瑞藥廠製泌尿科藥物「確得迅」(Cardura)的內地版本。文件內容指由於供應出現短缺,醫院會改用未經註冊的過渡性藥物,附上的新藥圖片中可見其包裝與香港有註冊的「確得迅」非常相似,惟盒面以簡體字印刷,寫上「可多华 甲磺酸多沙唑嗪缓释片」。

根據《藥劑業及毒藥規例》第36條規定,藥劑製品必須註冊後方可在香港銷售、要約出售、分發或管有為銷售、分發或作其他用途而管有藥劑製品,除非是用以輸往香港以外地方(1A)(a)(i)及(b)、製造或合成藥劑製劑(1A)(a)(ii)、將會用作臨牀試驗或藥物測試(1A)(c)及(d)、由註冊醫生或牙醫為治療某特定病人而管有或將會使用,或由註冊獸醫為治療某特定動物而管有或將會使用(1A)(ab),方可獲豁免註冊。
香港醫院藥劑師學會會長崔俊明表示,公立醫院使用的藥物均須經衞生署註冊,否則就是以Named Patient 方式(即法例所指由註冊醫生為治療某特定病人引入藥物),向衞生署遞交需要使用該藥的病人名稱,從而申請進口未經註冊藥物。他指醫管局除了用Named Patient方式引入特殊藥物,過去亦一直有以此引入因供應問題而需用作替代的未註冊藥物,即使是很普通的藥物,如果藥廠沒有在港註冊都可能會採用Named Patient申請進口。
香港公共醫療醫生協會會長馬仲儀表示,通常新藥及罕見病藥物才會以Named Patient形式引入,認為醫管局以此引入抗生素等常見藥物的做法奇怪,「如果藥房有10盒未註冊藥物是屬於Named Patient,即在這10盒藥下面有個名單,名單上的人才可使用這些藥。但抗生素我很難只限這些病人才可以用,因為它很常用,如果急症室突然來了新病人我都可能會用啊。」她質疑這些常見藥物應有很多不同藥廠製造,供應是否真的短缺到只有未經註冊的藥廠才可提供。
對於藥物安全,馬仲儀表示擔憂,「開藥是我的責任,但如果藥物本身從品質方面出現問題,而原來該藥又未有在衞生署完全註冊,那我處方又有沒有責任呢?」她指偶爾會收到藥房通知因轉換供應商而出現藥物包裝有所不同,但一般醫生用電腦系統處方藥物時,並不會知道該藥是否換了藥廠或有否註冊,病人更加不會知情,認為醫生有責任告訴病人,病人亦有權利知道。她解釋,透過Named Patient引入的新藥通常經由專科的中央統籌委員會(COC)討論及安排引入,該科醫生使用時會注意到該藥為未經註冊的新藥,但如果是其他常用藥物改用未註冊版本則未必會留意到。
崔俊明亦承認,藥劑師或配藥員通常不會主動告知病人有關藥物未經註冊,因為對病人而言藥物效用更為重要,「講給病人聽,他們會覺得:我怎知道你轉藥?為甚麼要告訴我?總之你不要發錯藥給我就行了。」對於使用未註冊藥物的安全問題,他認為醫管局有其社會責任,相信它沒有動機為省錢而購買來歷不明的藥物,而醫管局亦有委員會監察藥劑師採購藥物標準。
他形容醫管局要採購未註冊藥物有時是「很被動」,「迫不得已」才會用Named Patient,「其實Named Patient要做多很多工作,包括每次要多少枝、哪個病人用、用到何時等,全部都要上報衞生署。」他解釋藥物缺貨主要有三個原因,包括原材料不足、批次受到污染,以及藥廠不再在香港註冊,「藥廠不是看着香港做事,它覺得有生意才會在這裏註冊,譬如日本人口比香港多,可能它就沒有興趣在香港註冊。」
關注病人權益的香港社區組織協會幹事彭鴻昌認為,使用Named Patient形式去引入常用藥物的做法是「不理想」,因為那些並不是很特別或很新的藥物,現有供藥機制或有空間可避免相關情況,例如改善單一投標情況以令供藥更穩定。他認為現有資料下雖未見使用未註冊藥物對病人有很大影響,但相信仍存有一定風險,未知衞生署是否有權力監管。
彭鴻昌又認為醫院轉用未經註冊藥物時應該尊重病人知情權,扼要清楚地向他們交代因為甚麼原因而引入該藥、是否已通過安全評估等,從而令病人安心,否則病人自己發現正使用未經註冊藥物時會更不安,「始終未在香港註冊仍會有風險,有時都靠病人把關,如果使用藥物時出現某些狀況,他會知道如何向醫院或醫生交代,作為回饋讓醫院檢視藥物是否有問題。」
對於公立醫院使用藥廠原定供往其他國家的藥物,有藥廠人士透露,當藥廠預見藥物供應將出現問題時,除了會通知醫管局未能如期供貨,亦可能會主動提出應急計劃,建議醫管局採購藥廠原定於其他國家銷售、未經香港註冊的同款藥物,以維持本港供應。他指即使巿面上有其他藥廠生產、已註冊的同款藥物,醫管局亦會優先選擇原本藥廠的藥物,因為能夠確保藥物成份相同,程序上藥廠會向醫管局提交藥物化驗報告、包裝圖樣、貨版等,醫管局同時會預備正在使用該藥的病人名單,再向衞生署申請進口許可證,過程需時約一個月。
他指藥廠如果未能如期供貨,需要賠償醫管局另購替代藥物的差價,「從藥廠角度,沒有生意做還要被罰錢,我倒不如到外國採購由自己藥廠生產、純粹是包裝不同的藥物給你。」他以採購新加坡版本藥物為例,「它會罰我以香港價錢購買新加坡藥物,只不過新加坡賣的價錢跟香港一樣,這就等同沒有罰錢,因為醫管局只會罰差價。同一間公司生產應該沒有差價,沒理由新加坡分部去賺你香港分部的錢,至於運費成本則會由藥廠承擔。」
傳真社多次向醫管局查詢近年使用的未經註冊藥物資料,並引用《公開資料守則》提出索取有關資料,惟醫管局表示「沒有編備中央紀錄」而拒絕提供。
對於是否曾使用上述未經註冊藥物,醫管局未有正面回應,僅重申品質及安全是公立醫院採購藥物的首要考慮,並且得到衞生署許可才進口未經香港註冊的藥物。醫管局表示,「由於個別已在本港註冊的藥物有時會出現未能預計的供應問題,為確保病人得到適切的藥物治療,假如沒有其他選擇,公立醫院會需要進口一些未在香港註冊的藥物。假如有關藥物印上非英語的藥物標籤,醫院藥劑部職員會因應實際情況提供所需訊息給前線員工,確保用藥正確」,未有回應醫生及病人是否知悉該些藥物未經香港註冊。
傳真社同時向衞生署查詢是否曾就上述未經註冊藥物批出進口許可證,衞生署回覆指由於「涉及商業資料」,未能提供相關資料。衞生署又指根據《藥劑業及毒藥條例》,所有「藥劑製品」必須符合安全、療效及素質標準,並獲香港藥劑業及毒藥管理局批准註冊,方可在港售賣,但條例容許註冊醫生可以為治療特定病人而進口未經註冊的藥劑製品供管有及使用,衞生署會按既定機制,考慮個別情況,批准相關申請。根據該署資料,2018年至2019年間共批出約11,700張相關的進口證。
記者亦曾引用《公開資料守則》向衞生署索取過去5年所簽發的未經註冊藥物進口許可證數字及進口清單,該署回覆指基於相關資料「要透過不合理地使用部門的資源才能提供」,及「披露不完整或未完成的有關資料可能會令人產生誤解,或剝奪有關部門或任何其他人士發布資料的優先權或商業利益」,因此拒絕提供資料。
衞生署過去一直向市民宣傳應購買已在香港註冊的藥物,衞生署藥物辦公室網站亦提供香港註冊藥劑製品名單及搜尋器,讓市民查閱及核對藥物註冊資料。不過記者在調查中發現,註冊藥劑製品名單只顯示藥物的商業名稱、主要成份、持有該註冊的公司及其在港辦公室地址,沒有顯示藥物的生產商、生產地址及藥物包裝,不少藥物的劑量、濃度、形態(藥丸/注射溶液/藥膏等)資訊欠奉,難以核對藥物資訊。